Jak se naše tělo brání proti viru SARS-CoV-2
Vybrané pasáže byly přeloženy z odborné literatury, viz odkazy pod článkem – 04/2020.
V této hektické době koronavirové pohromy slýcháme pravidelná zpravodajství z celého světa o počtech nakažených, testovaných, obětech a zotavených, o způsobu chování v době krize a jak zvládat to celkové psychické zatížení.
Jen málo se však dovídáme o tom, jak vlastně za těchto podmínek funguje přirozená obrana těla proti tomuto nebezpečí. Mnohé viry v sobě nesou úžasné znaky designu, jako např. výkonný motor pro navíjení DNA („normálního“ viru, které DNA používají) a další velmi složité celky.
Faktem je, že někteří lidé prožívají po zasažení virem SARS-CoV-2 velmi závažný až fatální průběh, nicméně jiní se po celkem krátké době zotaví. Jak je náš imunitní systém navržen a vybaven, aby byl schopen bojovat proti nebezpečným virům?
V březnu 2020 informoval odborný časopis Nature Medicine o nové studii, kde vědci z australské Univerzity v Melbourne, Infekčního a imunitního institutu Petera Dohertyho odkrývají způsob, jak lidský imunitní systém zvyšuje svou reakci na nový koronavirus.
Byla zpracována případová studie s využitím informací jednoho z prvních pacientů zasažených infekcí SARS-CoV-2 v Austrálii. Byla to 47letá žena, která přijela z čínského Wuhanu do Melbourne. V době, kdy žena vyhledala nemocniční péči, pociťovala mírné až střední příznaky, ale jinak byla po všech stránkách zdravá.
Proto se vědci později zaměřili na to, jak dokáže imunitní systém reagovat na infekci novým koronavirem u jinak zdravého dospělého člověka. „Ukázali jsme, že v případě nákazy COVID-19 u jinak zdravého člověka byla s jeho klinickým zotavením spojena masivní imunitní reakce napříč různými typy buněk, podobně jako u chřipky,“ říká spoluautorka studie Katherine Kedzierska.1
Nárůst klíčových imunitních buněk
Žena vyhledala specializovanou péči 4 dny po zjištění příznaků virové infekce. Tyto příznaky zahrnovaly únavu, bolest v krku, suchý kašel, bolest na hrudi, dušnost a zvýšenou teplotu. Nicméně 11 dní po nástupu příznaků již mohla opustit nemocnici, vstoupit do karantény a 13. dne už byla bez příznaků.
Vědci ve své studii postupně analyzovali vzorky krve pacientky, odebírané 7., 8., 9. a 20. den po nástupu příznaků. „Podívali jsme se u této pacientky na celou šíři imunitní reakce s využitím znalostí, které jsme nashromáždili za mnoho let sledování u pacientů hospitalizovaných s chřipkou,“ vysvětluje spoluautorka studie Dr. Oanh Nguyen.
Vědci zjistili, že během 7–9 dnů po nástupu příznaků došlo k velkému nárůstu imunoglobulinu G – což je nejběžnější typ protilátky – který přispěchal na pomoc v boji proti viru. Zvýšilo se také množství imunoglobulinu M. Podle analýz pokračovalo toto navýšení imunoglobulinů až do 20. dne po nástupu příznaků.
V 7–9 dnech po nástupu příznaků bylo ve vzorcích krve pacienta také velké množství specializovaných pomocníků, jako jsou T buňky, zabíječské T buňky a B buňky – všechny jsou to klíčové buňky imunitního systému.
To svědčí o tom, že tělo pacientky účinně používalo proti novému viru celou řadu různých „zbraní“. „Tři dny po přijetí pacientky jsme viděli velký nárůst populace určitých imunitních buněk, které jsou často známkou zotavení během sezónní infekce chřipky, takže jsme předpověděli, že se pacient zotaví za 3 dny, a tak se i stalo, “poznamenává Dr. Nguyen.
Imunitní reakce na viry
Autor článku na Immunology.org Kerry Laing popisuje postup, jakým se imunitní systém brání proti napadení nežádoucích virů. Reakci rozděluje do tří hlavních částí:2
1. Pomocí cytotoxických buněk
Pokud virus napadne člověka (hostitele), útočí na jeho buňky, aby přežil a mohl se dál množit. Jakmile je vir uvnitř buňky, imunitní systém ho „nevidí“, a tudíž ani neví, že je hostitelská buňka infikována. K překonání tohoto problému používají imunitní buňky systém, který jim umožňuje ukázat ostatním buňkám, co je v nich – používají molekuly zvané proteiny třídy I. hlavního histokompatibilního komplexu (MHC třídy I) k zobrazování částí proteinu z vnitřku buňky na buněčném povrchu. Pokud je buňka infikována virem, budou tyto části peptidu obsahovat fragmenty proteinů vytvořených virem.
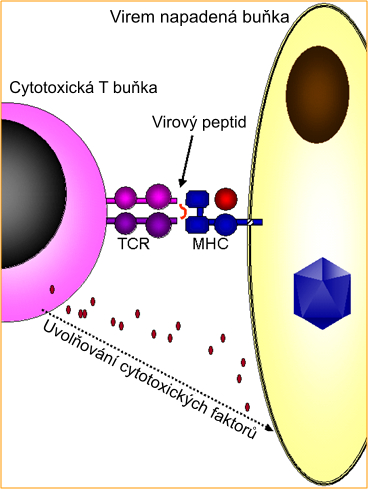
Speciální buňka imunitního systému zvaná T buňka cirkuluje a hledá narušitele. Jeden typ T buněk se nazývá cytotoxická T buňka, protože zabíjí buňky napadené virem toxickými mediátory. Cytotoxické T buňky mají na svém povrchu speciální proteiny, které jim pomáhají rozpoznávat virem infikované buňky. Tyto proteiny se nazývají receptory T buněk (TCR). Každá cytotoxická T buňka má tyto receptory TCR, které umí specificky rozpoznávat konkrétní antigenní peptid navázaný na MHC molekulu. Pokud receptor T buněk detekuje peptid z viru, varuje svou T buňku před infekcí. T buňka uvolňuje cytotoxické faktory, aby infikovanou buňku zabila, a zabránila tak přežití napadajícího viru (obrázek 1).
Viry se však umí detekci T buňkami často vyhnout. Některé totiž zabraňují molekulám MHC dostat se na buněčný povrch a zobrazovat virové peptidy. Pokud k tomu dojde, T buňka pak neví, že uvnitř infikované buňky je virus.
Na to se však specializuje jiná imunitní buňka – ta zabíjí buňky, které mají na svém povrchu snížený počet molekul MHC I. třídy. Je to tzv. NK buňka (natural killer cell). Když NK buňka najde buňku vykazující méně než obvyklý počet molekul MHC, uvolňuje toxické látky, podobně jako cytotoxické T buňky, a tím zabije virem infikovanou buňku.
Cytotoxické buňky jsou vyzbrojeny předem vytvořenými mediátory. Cytotoxické faktory jsou ukládány uvnitř prostoru zvaného granule, a to v cytotoxických T buňkách i NK buňkách, dokud kontakt s infikovanou buňkou nespustí jejich uvolnění. Jedním z těchto mediátorů je perforin – to je protein, který může vytvářet póry v buněčných membránách; tyto póry umožňují vstup dalších faktorů do cílové buňky pro usnadnění její destrukce. Enzymy zvané granzymy jsou také uloženy v granulích a uvolňují se z nich. Granzymy vstupují do cílových buněk otvory vytvořenými perforinem.
Jakmile jsou uvnitř cílové buňky, zahájí proces známý jako programovaná buněčná smrt neboli apoptóza, která způsobí smrt cílové buňky. Dalším uvolňovaným cytotoxickým faktorem je granulysin, který přímo útočí na vnější membránu cílové buňky a ničí ji lýzou. Lýza znamená rozklad či destrukci, a to nejčastěji smrtí buněk v důsledku rozkladu jejich vnější membrány. Cytotoxické buňky také po kontaktu s infikovanými buňkami nově syntetizují a uvolňují další proteiny, nazývané cytokiny. Cytokiny obsahují faktor interferon-g a faktor nádorové nekrózy-a a přenášejí signál z T buňky do infikovaných nebo jiných sousedních buněk, aby byly zajištěny mechanismy zabíjení buněk.
2. Pomocí interferonů
Virem infikované buňky produkují a uvolňují malé proteiny zvané interferony, které hrají důležitou roli v imunitní ochraně před viry. Interferony brání množení virů tím, že přímo narušují jejich schopnost replikace v infikované buňce. Působí také jako signalizační molekuly, které umožňují infikovaným buňkám varovat blízké buňky o přítomností viru – tento signál způsobuje, že sousední buňky zvyšují na svém povrchu počet molekul MHC třídy I, takže T buňky zkoumající oblast je mohou identifikovat a virovou infekci odstranit, jak je popsáno výše.
Interferony tedy stimulují antivirovou odpověď vrozeného imunitního systému, čímž se nyní také zabývají světové laboratoře v souvislosti s léčbou nemoci COVID-19. V laboratoři interferony vykazují účinnou schopnost potlačovat replikaci viru SARS. Současný výzkum ukázal, že netopýři jsou doslova líhní koronavirů. Mají totiž silně účinný a robustní imunitní systém, takže jim samotným viry neublíží.
Jedním z mechanismů imunitního systému netopýrů v reakci na viry je okamžité spuštění bleskové produkce signální molekuly zvané interferon-alfa. Virem infikované buňky vylučují interferony a buňky v okolí ihned přecházejí do obranného, antivirového stavu.3 Pokud se však virům z netopýrů podaří přeskočit na jiné druhy zvířat, včetně lidí, imunitní systémy příjemců nejsou ani zdaleka tak vybaveny k odpovídající imunitní odpovědi a infekci nedokáží čelit.
3. Pomocí protilátek
Viry mohou být také odstraněny z těla protilátkami ještě dříve, než dostanou šanci infikovat buňku. Protilátky jsou proteiny, které specificky rozpoznávají napadající patogeny a vážou se na ně (lepí se). Tato vazba slouží k mnoha účelům při vymýcení viru:
-
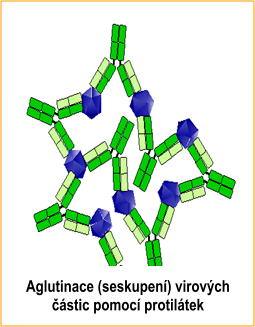
Obrázek 2 Za prvé, protilátky virus neutralizují, což znamená, že již není schopen infikovat hostitelskou buňku.
- Za druhé, mnoho protilátek může vzájemně spolupracovat, a tím mohou virové částice donutit k seskupení v procesu zvaném aglutinace. Aglutinované celky virů jsou pro imunitní buňky snazším cílem než jednotlivé viry.
- Třetím mechanismem k vymýcení virů pomocí protilátek je aktivace fagocytů. Protilátka vázaná na virus se váže na receptory nazývané Fc receptory na povrchu fagocytárních buněk a spouští mechanismus známý jako fagocytóza, při němž buňka pohlcuje virus a tím ho zničí.
- Protilátky mohou také aktivovat zvláštní režim opsonizace, kterým podporují fagocytózu virů. Systém může také poškodit vnější vrstvu (fosfolipidovou dvojvrstvu), která se vyskytuje u některých virů.
Závěr
Rozsáhlý výzkum imunitního systému u velkého množství zvířat, a především lidí, popisuje velmi detailně jak některé podobnosti, tak i rozdíly mezi jednotlivými imunitními systémy. Nicméně neposkytuje žádný důkaz nějakého evolučního vývoje těchto komplexních, nezjednodušitelných systémů.
Ukázalo se, že vrozené imunitní systémy dříve považované za velmi primitivní jsou mnohem složitější, než se dříve věřilo.4 Různé živočišné kmeny využívají „pozoruhodně rozsáhlou škálu řešení, která splňují v zásadě stejné požadavky na ochranu hostitele“.5 Díky obrovské nesourodosti mezi různými variacemi imunitního systému v říši zvířat je proto vysoce nepravděpodobné, že by se jeden systém vyvíjel v jiný.
Složitě navržené procesy používané k produkci rozmanitých protilátek a poté k doladění adaptivní imunitní reakce nejsou důkazem darwinovské evoluce, ale jednoznačně vykazují svou sofistikovanou konstrukcí otisk té nejvyšší inteligence, která také stála u samého počátku stvoření – biblický Bůh.
Odkazy a poznámky
- Natur Medicine: Breadth of concomitant immune responses prior to patient recovery: a case report of non-severe COVID-19. 16. března 2020.
- Kerry Laing, Centrum pro výzkum rakoviny Fred Hutchinson, Seattle, USA.
- Peter Dockrill, Nature: There’s Something Special About Bat Immunity That Makes Them Ideal Viral Incubators. 12. února 2020.
- Press release, University of Florida, October 3, 2006.
- Litman a jeho tým, ref. 2, str. 866